1. Des noyaux stables aux noyaux radioactifs.
La matière solide, liquide ou gazeuse est formée d’atomes, individuels ou assemblés en cristaux et molécules. Les atomes eux-mêmes sont constitués d’un noyau qui rassemble la quasi-totalité de leur masse et d’électrons, particules de très faible masse porteuse d’une charge électrique négative. En fait, l’atome est surtout constitué de vide : si un atome avait la taille d’une nef de cathédrale, le noyau aurait celle d’un gros bourdon vrombissant au milieu du choeur.
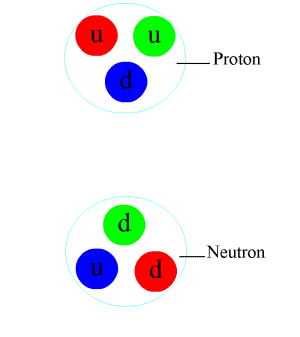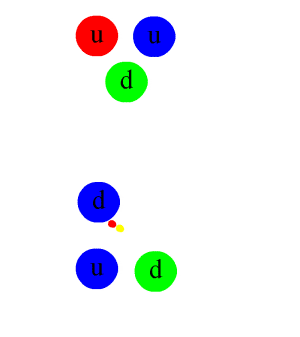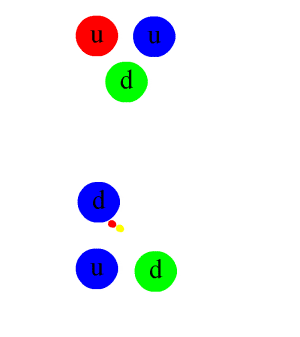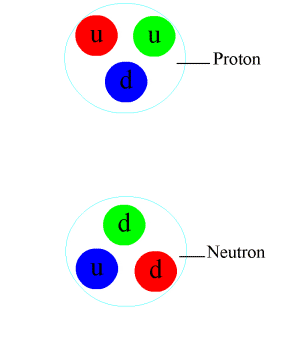
Le noyau est un assemblage de particules massives, les nucléons : la masse d’un nucléon est plus de 1800 fois la masse d’un électron. Les nucléons se répartissent entre les protons qui portent une charge électrique positive et les neutrons qui ne sont pas chargés. Le nombre de protons d’un noyau détermine son espèce chimique (1 proton = hydrogène, 2 = hélium, 6 = carbone, etc.). On note A, le nombre de nucléons ou masse atomique, et Z, le nombre de protons ou numéro atomique. Les atomes de même Z dont les nombres A diffèrent sont des isotopes d’un même élément. Leurs propriétés chimiques (liées aux protons) sont presque identiques, mais leurs propriétés nucléaires peuvent être très différentes. On note couramment les isotopes par leur symbole chimique précédé de leur masse atomique en exposant : 1H, 4He, 12C, 16O, 235U…
Les électrons sont répartis sur des couches plus ou moins éloignées du noyau. Les électrons périphériques jouent un rôle principal dans les réactions chimiques. Dans une molécule, les atomes mettent plus ou moins en commun ces électrons périphériques. Un atome possède le même nombre de protons et d’électrons : il est électriquement neutre. Si les deux nombres diffèrent, l’atome est dit ionisé – mais il garde la nature chimique déterminée par ses protons. S’il a un excès d’électrons, c’est un ion négatif, ou anion (exemple : Cl–, O—), dans le cas contraire, c’est un ion positif, ou cation (exemple H+, Ca++).
Dans le noyau, les neutrons assurent la cohésion des protons qui, sans eux, se repousseraient mutuellement, ayant une charge électrique identique. Plus un noyau comporte de nucléons, plus il faut que le nombre de neutrons excède celui des protons pour que l’assemblage reste stable : c’est ainsi que les noyaux d’atomes présents dans la nature se situent dans ce qu’on appelle la « vallée de stabilité » sur un diagramme comparant le nombre de protons et le nombre de neutrons des noyaux.
Si un noyau a trop, ou pas assez de neutrons, il est instable, et tendra à rejoindre, plus ou moins vite, la vallée de stabilité, en se désintégrant selon un des mécanismes décrits au chapitre suivant. Cette désintégration s’accompagne d’une émission d’énergie et de rayonnements : c’est ce qu’on appelle la radioactivité.
On oppose souvent radioactivité naturelle et radioactivité artificielle : c’est un abus de langage, il n’y a qu’une radioactivité, mais elle peut venir de noyaux présents naturellement sur Terre (et notamment dans le corps humain qui contient naturellement du potassium 40K, et du carbone 14C ou de noyaux fabriqués artificiellement dans des accélérateurs de particules ou des réacteurs nucléaires. Les éléments radioactifs naturels peuvent être issus directement de la nucléosynthèse dans les étoiles et les supernovæ, comme le potassium 40K et l’uranium 238U. Ils peuvent aussi être formés lors d’interaction de noyaux préexistants avec des particules du rayonnement cosmique, comme le carbone 14C. Ils peuvent enfin provenir de la désintégration d’un autre noyau radioactif, comme le radium, descendant de l’uranium.
Chaque isotope radioactif – on dit aussi radionucléide – est caractérisé par le rythme de sa désintégration. On appelle période, ou parfois demi-vie, et on note T½, la durée au bout de laquelle exactement la moitié d’un nombre donné de noyaux se sera désintégré. La période est une donnée statistique : il est impossible de prédire à quel moment un noyau radioactif individuel se désintégrera, mais si on part d’un milliard de ces noyaux, on connaît avec une extrême précision quand il n’en restera plus que 500 millions. Et cette période caractéristique d’un noyau précis peut aller d’une fraction de milliseconde à quelques milliards d’années… (voir tableau 1).
Dans les médias, la période est souvent appelée « durée de vie » et les commentaires associés laissent entendre que plus longue est sa durée de vie, plus un atome radioactif est dangereux… C’est exactement l’inverse : si la période est longue, c’est que le rythme de désintégration est lent, et donc que l’activité est faible !
On dirait que ça t'intéresse. Clique ici pour lire la suite!